基础医学院占昌友研究员团队在脑靶向脂质体药
近日,复旦大学基础医学院占昌友研究员团队设计了一种新颖的脑靶向脂质体药物,血液循环过程中可精准“钓”取内源性载脂蛋白并维持其生物活性,实现高效的脑靶向药物递送。
8月8日,相关成果以《精准调控蛋白冠中血浆蛋白功能实现脑靶向药物递送》(Brain-targeted Drug Delivery by Manipulating Protein Corona Functions)为题,在线发表于《自然通讯》(Nature Communications)。脂质体是当前临床应用最为广泛的一类纳米药物载体。靶向脂质体药物是将脂质体表面修饰上功能性分子(如小分子、多肽和抗体等),以期突破药物递送过程中的生理屏障(如血脑屏障、血眼屏障和生物膜屏障等),实现药物在靶部位的蓄积,从而提高疗效并降低毒副作用。

靶向脂质体药物的相关研究在过去近40年时间内十分活跃,但至今仍未实现临床转化。越来越多的研究发现,体内递送过程中血浆蛋白吸附在靶向脂质体药物表面形成蛋白冠,较大程度上影响靶向分子的生物活性,并可能影响药物的生物分布,加剧毒副作用。如占昌友团队前期研究发现,天然免疫球蛋白IgM易吸附在荷正电稳定型脑靶向长肽修饰的脂质体药物表面,导致血循环时间短,增加肝脾蓄积,产生较强的免疫原性(Nature Communications 2018, 9, 2982. Molecular Pharmaceutics 2019, 16, 907.)。
靶向脂质体药物的临床转化急需从源头设计调整思路。血浆中存在多种载脂蛋白可跨越血脑屏障,而脑内Aβ蛋白的清除机制之一,是通过结合多种载脂蛋白(如ApoE、ApoA1和ApoJ)的脂质结合区域,同时暴露受体结合区域,经血脑屏障上对应的受体介导转运至外周。因相关受体可双向转运,亦可将外周配体转运至脑内。
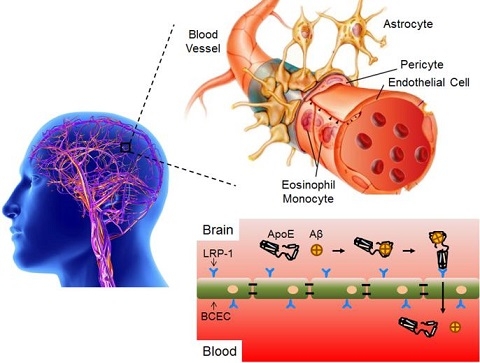
研究人员仿生Aβ蛋白设计获得无毒短肽,修饰在脂质体表面后,在血液循环过程中主动吸附目标载脂蛋白的脂质结合区域,同时将受体结合区域暴露在脂质体表面,发挥高效脑靶向性作用。该目标短肽修饰的脂质体载抗肿瘤药阿霉素后,成功治疗多种原位脑肿瘤(脑胶质瘤和髓母细胞瘤),均显著延长模型鼠的中位生存期。